载脂蛋白能杀菌?人体“天然去污剂”APOL3可消灭胞内病原体
为了进一步阐明内在机制,作者设计了报告菌株来追踪细胞内Stm的命运。Stm 内膜(IM)完整性可以通过 minD 跟踪,minD 是一种细菌细胞分裂蛋白,当 IM 电位受到扰动时会失去其侧膜振荡行为【1】,存在APLO3的情况下,Stm的IM 定位和振荡的损失程度显着升高。超分辨结构光镜 (SIM)和冷冻免疫电镜证实 APOL3 能够突破细菌外膜(OM),进入细菌胞质中并在不久后清除细菌。
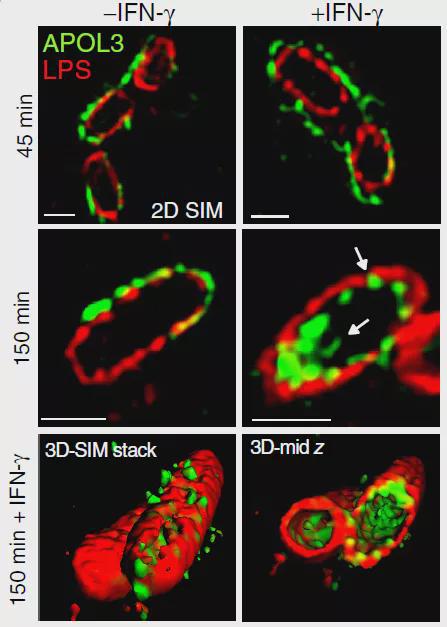
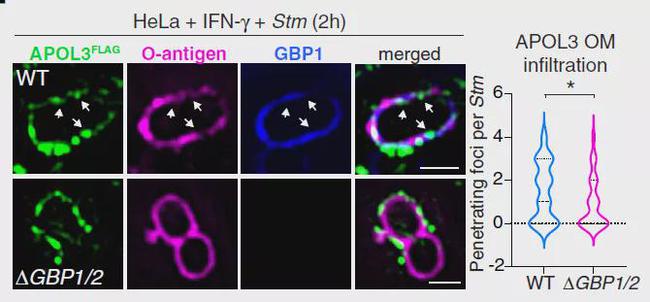
以上结果提示APOL3可以直接发挥抗菌作用,但需要注意的是这些影响仅在IFN-γ激活的人类细胞内的细菌中才能观察到,此外,作为细菌OM渗透屏障必要成分的LPS O抗原显示出不规则的染色,作者考虑是否有其他ISGs协助APOL3来削弱细菌OM的屏障作用呢?Galectin-8、p62/SQSTM1 和GBP1是针对人体细胞中侵入细胞质的细菌的防御蛋白,其中,GBP1 属于 IFN-γ诱导型GTPase家族,已知其能协助LPS反应性caspase-4炎症小体启动细胞焦亡【2】。因此,作者认为GBP1可能作为候选ISGs。为了验证这个想法,作者构建了APOL3/GBP1双敲除细胞,此时,提取的Stm不易被外源性重组APOL3杀死。如果用重组GBP1处理Stm后,足以增加Stm对外源性重组APOL3的杀伤敏感性,从而证明了GBP1和APOL3在这一过程中的协作关系。
那么APOL3如何区分并渗透进入细菌膜呢?作者制备了模拟细菌或哺乳动物膜成分的脂质体,发现前者对 rAPOL3 通透性是后者的10 倍以上。一组成分不同的脂质体靶向测试表明,这种选择性源于对天然富含于细菌膜的酸性磷脂的偏好,以及对真核生物细胞膜上胆固醇的排斥。
最后,针对APOL3如何进入细菌膜,作者分别通过实时吸光度跟踪和负染EM 直接观察到APOL3能够将阴离子脂质体溶解成“盘状”脂蛋白复合物,以及通过高能非变性质谱(nativeMS)【3】来研究膜溶解过程中APOL3的结构动力学,观察到在水溶液中,APOL3 作为部分无序的“开放”单体存在,其暴露的表面积在电离过程中积累了许多正电荷,而在与脂质体结合后,APOL3 发生显着变化,采用与多个脂质加合物相关的低电荷状态紧密折叠的“闭合”构象异构体,证实了脂蛋白颗粒组装。

革兰氏阴性菌的双层膜使它们异常难以杀死,OM通透剂结合抗生素的联合疗法已成为一种有希望的治疗选择【4】。这一研究表明,人类已经进化出一种类似的细胞自卫策略,“天然去污剂”APOL3协同GBP1突破双层膜防线,进入敌军内部,一旦进入,即可将IM溶解成盘状脂蛋白复合物从而发挥其广谱溶膜活性。总的来说,这项研究强调了人类 APOL3 作为部署在非免疫细胞内以对抗细胞内病原体的杀菌作用。