揭秘gRAMP CRISPR-Cas效应蛋白实现适应性免疫的新机制
撰文 | 徐颖
责编 | 酶美
CRISPR-Cas系统是原核生物的一种获得性免疫防御系统:入侵者进入宿主细菌后,其基因被加工成间隔序列(spacer)储存在CRISPR重复序列之间形成免疫记忆;当其再次侵入时,原核生物的效应复合体迅速响应,识别外源序列并使其失活(图1)。CRISPR-Cas效应复合体由Cas蛋白(CRISPR-associated protein)组成,能够与crRNA结合。外源核酸片段整合到基因组上后,可以在CRISPR位点启动子的控制下进行转录,合成包含一系列重复序列及间隔序列的RNA分子,即前体CRISPR RNA(pre-crRNA)。随后,细菌内cas蛋白将其进一步加工,在CRISPR重复序列的特定位点进行剪切,从而形成的由重复序列和一个间隔序列组成的CRISPR RNA,简称为crRNA。crRNA与外源靶标核酸能够互补结合,当检测到入侵者的痕迹时,启动免疫反应。
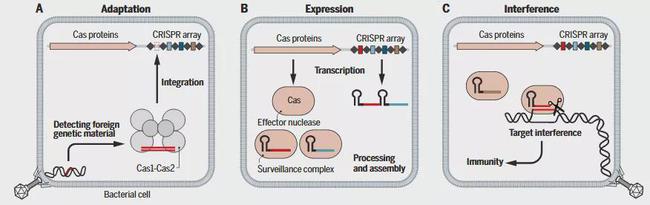
图1. CRISPR-Cas适应性免疫。(A)适应:Cas1-Cas2复合体获得外源性片段,并将其整合到CRISPR基因簇中;(B)表达:CRISPR基因簇经过翻译和加工形成crRNA,其相关Cas蛋白,即Cas效应核酸酶表达,而后二者经过加工和组装形成一个核糖核酸复合体——监控复合体;(C)干扰:效应核酸酶通过crRNA与外源核酸互补配对,使外源片段降解【1】。
III型CRISPR-Cas免疫在原核生物中广泛存在,通常由多亚基效应复合物介导。近期,一种类似III型系统的新的CRISPR-Cas亚型被生物信息学预测并归类为III-E型。典型的III型系统的效应蛋白由多个蛋白亚基构成,而III-E型的效应蛋白是由多个重复相关的神秘蛋白(repeat associated mysterious protein,RAMP)结构域融合而成,因此又称之为gRAMP(giant RAMP)。gRAMP具有1300-1900个氨基酸,是迄今为止发现的最大的单亚基效应蛋白。TPR-CHAT(tetratrico-peptide repeat,TPR)预测是来自caspase家族的蛋白酶,其成员通常催化靶蛋白中特定肽键的水解,是一种caspase-like肽酶,其功能还有待鉴定。
2021年8月27日,荷兰代尔夫特理工大学(Delft University of Technology)Stan J. J. Brouns团队在Science杂志上发表文章 The gRAMP CRISPR-Cas effector is an RNA endonuclease complexed with a caspase-like peptidase,揭示来自厌氧氨氧化菌(Candidatus "Scalindua brodae")的III-E型效应蛋白(简称Sb-gRAMP),是一种能与TPR-CHAT形成复合体的核糖核酸内切酶,它可能通过靶标RNA激活TPR-CHAT肽酶的蛋白酶活性获得病毒免疫。

研究人员发现插入III-E型CRISPR基因簇的间隔序列偏好靶向开放阅读框的编码链,表明gRAMP活性可能与入侵者的mRNA相互作用。一些III-E型基因座携带与逆转录酶融合的Cas1,暗示III-E型获得机制可能是从RNA中获取间隔序列。
但奇怪的是,gRAMP基因簇缺乏辅助核酸酶基因,却经常与编码TPR-CHAT蛋白的基因共同出现。因此研究人员推测caspase家族与CRISPR-Cas系统III-E型的抗病毒活性存在一定的功能关系,并在本研究中进行验证。
研究人员用大肠杆菌系统共表达了Sb-gRAMP和crRNA(含5个间隔序列),通过Strep亲和层析、肝素亲和层析和凝胶阻滞层析(SEC)获得高纯度的Sb-gRAMP-crRNA复合物。多角度光散射(MALS)分析表明得到的复合物是由一个Sb-gRAMP单体与44-60 nt的ssRNA结合形成的。
“Scalindua brodae” III-E型基因座包含一个CRISPR基因簇,后者由36nt的重复序列和11个间隔序列组成。为了进一步分析成熟crRNA的特征,研究人员通过PCR扩增、RNA提取和RNAseq等实验证明该RNA包含一个27-28nt长的5’-手柄,其末端具有14nt保守的重复序列,大多数成熟crRNA被切割。研究人员发现Sb-gRAMP能够结合带有不同拷贝间隔序列的crRNA,并且其中缺乏参与pre-crRNA加工的基因,因此推测Sb-gRAMP可能类似Cas12和Cas13,能够自行加工pre-crRNA。
Sb-gRAMP能够识别靶标RNA,并在相距6nt的两个特定位点对单链RNA进行切割,对ssDNA或非互补ssRNA无切割活性。因此,研究人员认为Sb-gRAMP是一种序列和位置特异性的crRNA指导的核糖核酸内切酶,其RNase活性依赖于金属离子。
由于四肽重复序列(TPR)结构域通常参与蛋白-蛋白的相互作用以及蛋白复合物的形成。因此研究人员在细胞内共表达带有不同融合标签的TPR-CHAT和和Sb-gRAMP-crRNA,并互为钓饵,结合MALS实验结果,发现Sb-gRAMP-crRNA能够和TPR-CHAT以1:1的比例结合形成稳定的复合体,并将这一复杂的复合体命名为Craspase(CRISPR-guided Caspase)。
III-E型gRAMP效应蛋白既具有I类CRISPR-Cas系统的特征(多个结构域,6nt切割间距,PFS和RNA切割位点相互独立),也具有II类CRISPR-Cas系统的特征(效应蛋白为单一蛋白),模糊了传统的CRISPR-Cas系统分类。尽管gRAMP-crRNA具有特异性切割RNA的能力,能够有助于抗病毒防御,但在III-E型CRISPR-Cas系统中靶标RNA识别和切割的主要作用是充当Caspase的开关。
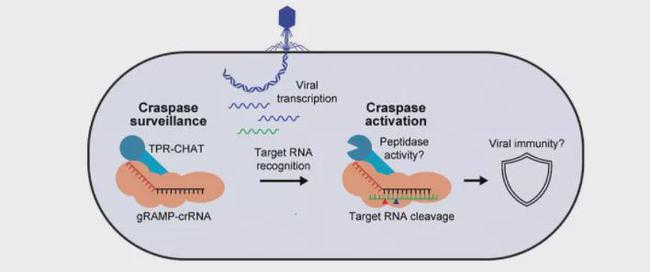
在其他III型CRISPR-Cas系统中,RNA靶向作用可以调节第二信使的产生,从而调控辅助核酸酶的活性。然而,该研究发现Sb-gRAMP-crRNA靶向RNA,并与TPR-CHAT形成稳定的复合物产生一个模型,其中Sb-gRAMP-crRNA并不是使用第二信使,而是在靶标RNA识别时变构诱导肽酶活性,从而引发特定的免疫反应。
原文链接:
https://science.sciencemag.org/content/early/2021/08/25/science.abk2718
参考文献
1. Gavin J. Knott,Jennifer A. Doudna. CRISPR-Cas guides the future of genetic engineering. DOI: 10.1126/science.aat5011
来源:BioArt
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“明珠号”用户上传并发布,本平台仅提供信息存储服务。
-
 家 最新研究发现,这种水果是“降酸王”,尿酸高人群建议多吃!
家 最新研究发现,这种水果是“降酸王”,尿酸高人群建议多吃! -
 3 为啥印度能成为“世界药房”,生产便宜的仿制药,中国却不行?
3 为啥印度能成为“世界药房”,生产便宜的仿制药,中国却不行? -
 健 西瓜、葡萄、水蜜桃……这些水果一定要这样吃
健 西瓜、葡萄、水蜜桃……这些水果一定要这样吃 -
 初 夫妻之间多久同房一次才是正确的,有利于子宫健康的呢?
初 夫妻之间多久同房一次才是正确的,有利于子宫健康的呢? -
 健 西瓜、葡萄、水蜜桃……这些水果一定要这样吃
健 西瓜、葡萄、水蜜桃……这些水果一定要这样吃 -
 医 这3种癌被称为“夫妻癌”,夫妻一人出现,另一半要赶紧检查!
医 这3种癌被称为“夫妻癌”,夫妻一人出现,另一半要赶紧检查! -
 不 方便面怎么吃才健康?营养师:其实很简单,搭配这个就行
不 方便面怎么吃才健康?营养师:其实很简单,搭配这个就行 -
 治 有的人喝完水后尿很多,有的人却无尿,哪样好?别全怪肾不好
治 有的人喝完水后尿很多,有的人却无尿,哪样好?别全怪肾不好 -
 治 身体越“硬朗”说明越健康?有些部位越软,身体越健康
治 身体越“硬朗”说明越健康?有些部位越软,身体越健康 -
 上 身体“三处”堵,病痛来一身,我们赶紧“通一通”!
上 身体“三处”堵,病痛来一身,我们赶紧“通一通”! -
 大 假如人得过一次癌症,会不会像其它病一样产生“抗体”?
大 假如人得过一次癌症,会不会像其它病一样产生“抗体”? -
 医 身上若出现6种表现,当心肾功能已下降,及时检查,不能拖
医 身上若出现6种表现,当心肾功能已下降,及时检查,不能拖








































