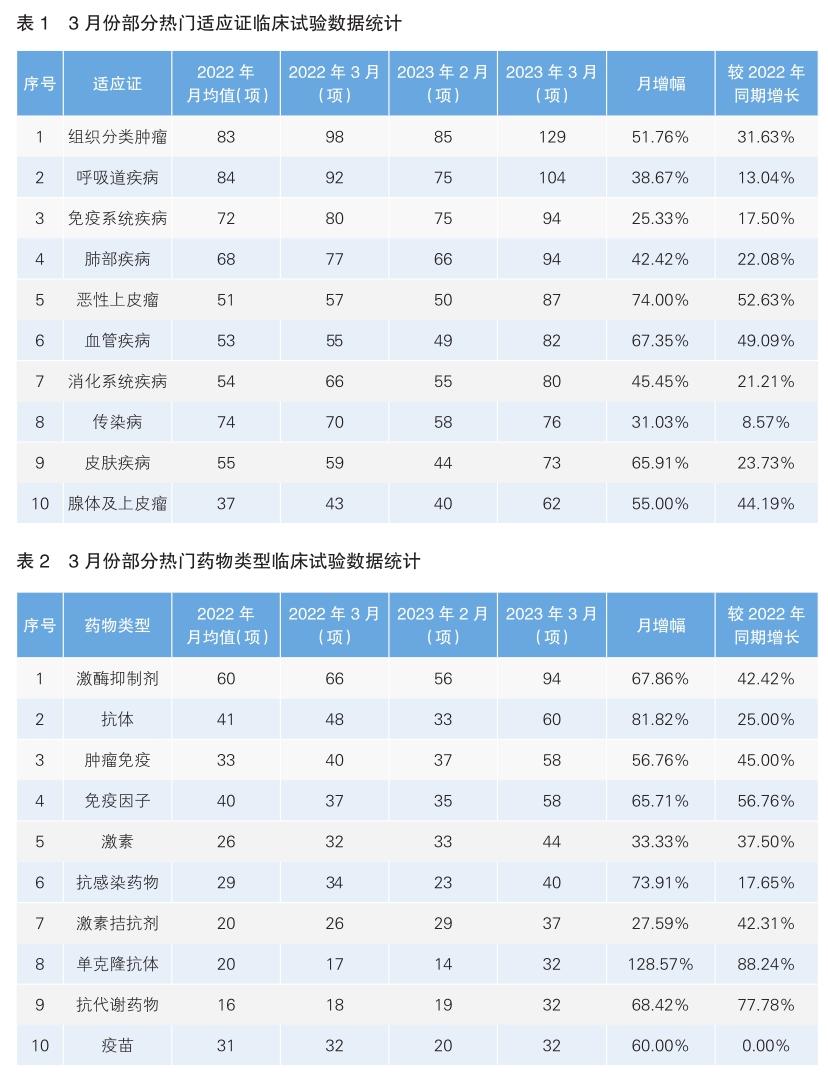
恶性上皮瘤与血管类疾病药物研发升温
本文转自:中国医药报
3月份美国Clinicaltrial数据库临床试验数据显示——
恶性上皮瘤与血管类疾病药物研发升温
□ 陈宇哲
根据美国Clinicaltrial数据库数据,今年3月份,全球新增由企业资本主导的临床试验总数为884项,新开临床试验数量较2月份增长39.65%。单月新增临床试验数量显著高于上年同期水平,同比增长14.21%。
3月份,申报临床试验数量最多的企业(机构)是阿斯利康,申报数量为20项;其次为默沙东,数量为19项;随后为辉瑞,数量为18项。在全球单月新开临床试验数量排名前十的企业中,增幅最大的是武田,数量从上个月的5项增加至本月的16项,月增幅3.2倍;增幅超过100%的企业还有艾伯维和罗氏,月增幅分别为1.75倍及1.17倍。
对比前三名临床试验申报企业(阿斯利康、默沙东、辉瑞)在临床适应证方面的分布可知,竞争最为激烈的领域为组织分类肿瘤,其次为肺部疾病和呼吸道疾病领域。
组织分类肿瘤领域新开临床试验情况
在组织分类肿瘤领域,默沙东和辉瑞3月份布局的临床试验最多,均有5项;其次为阿斯利康(4项)。
默沙东的新开临床试验包括1项Ⅲ期、3项Ⅱ期和1项早Ⅰ期临床试验。Ⅲ期临床试验的试验药物为Nemtabrutinib(MK-1026,曾用名ARQ-531),是第二代BTKi,是野生型和C481S突变体布鲁顿酪氨酸激酶(BTK)的可逆双重抑制剂,适应证为慢性淋巴细胞白血病(NCT05624554),该试验曾计划于今年2月份启动,后推迟至3月。其余临床试验的主申请人均不为默沙东,默沙东均作为第二或第三位申请人申报。在3项Ⅱ期临床试验中,有1项试验(NCT05756569)为Enfortumab Vedotin与帕博利珠单抗(Pembrolizumab)联合疗法在膀胱鳞状细胞癌中的效果,主申报人为美国埃默里大学;另一项临床试验(NCT05619913)的主申请人为美国乔治城大学,试验药物为BXCL701(Talabostat),这是一种首创的二肽基肽酶(DPP)口服小分子抑制剂,适应证为胰腺导管腺癌;剩下一项临床试验的主要申报单位为澳大利亚和新西兰妇科肿瘤小组,主要试验药物为Eribulin Mesylate(甲磺酸艾日布林),这是一种合成的大田软海绵素类似物,由日本卫材公司研发,剂型为注射液,用于治疗局部晚期或转移性乳腺癌患者,该试验的适应证为卵巢癌肉瘤。一项早Ⅰ期临床试验(NCT05733715)的主要申请人为Abramson Cancer Center at Penn Medicine,为帕博利珠单抗与Lenvatinib联合疗法,适应证为肾细胞癌。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“明珠号”用户上传并发布,本平台仅提供信息存储服务。
-
 英 美国网女红想整成三围逆天版卡戴珊,最近一次整形手术后意外去世
英 美国网女红想整成三围逆天版卡戴珊,最近一次整形手术后意外去世 -
 小 阿利沙坦酯适用哪些人群?一文科普下
小 阿利沙坦酯适用哪些人群?一文科普下 -
 凤 孙俪否认自己眼睛大是得了甲亢:是从小就大的
凤 孙俪否认自己眼睛大是得了甲亢:是从小就大的 -
 小 这些妇科知识,女性必须知道,不知道一定后悔,看看吧
小 这些妇科知识,女性必须知道,不知道一定后悔,看看吧 -
 人 新变异株是否会突破免疫屏障?当前疫情防控热点八问八答
人 新变异株是否会突破免疫屏障?当前疫情防控热点八问八答 -
 小 胃黏膜的“修复器”被找到了,每天吃一点,或能修复黏膜
小 胃黏膜的“修复器”被找到了,每天吃一点,或能修复黏膜 -
 新 新研究:生理压力导致的加速衰老是可逆的
新 新研究:生理压力导致的加速衰老是可逆的 -
 健 男人容易胖肚子,女人容易胖屁股,该如何减肥?
健 男人容易胖肚子,女人容易胖屁股,该如何减肥? -
 英 炒面炒饭配薯条咖喱?英式中餐外卖过于黑暗,连美国网友都看不下去了…
英 炒面炒饭配薯条咖喱?英式中餐外卖过于黑暗,连美国网友都看不下去了… -
 盖 博主周六野自曝患病,因前男友长六颗子宫肌瘤!呼吁女生爱惜自己
盖 博主周六野自曝患病,因前男友长六颗子宫肌瘤!呼吁女生爱惜自己 -
 新 不想被盯着看,她们决定去女子健身房
新 不想被盯着看,她们决定去女子健身房 -
 澎 32岁女子患乳腺癌,38次放化疗后保住乳房并诞下龙凤胎
澎 32岁女子患乳腺癌,38次放化疗后保住乳房并诞下龙凤胎








































