两日两项!JAK抑制剂再获FDA批准
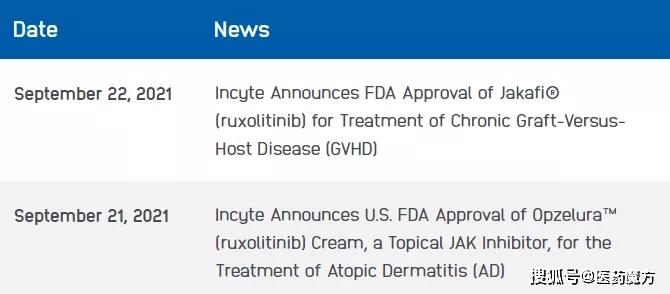
9月22日,Incyte宣布,美国FDA已批准Jakafi (ruxolitinib,芦可替尼)补充新药申请(sNDA),用于治疗成人和12岁及以上儿童患者类固醇难治性慢性移植物抗宿主病(GVHD),早在2019年,FDA已批准芦可替尼用于治疗成人和12岁及以上儿童患者类固醇难治性急性GVHD。
移植物抗宿主病(GVHD)是异基因造血干细胞移植(供体干细胞移植)的主要并发症。患者接受异体肝细胞移植后,供体细胞会启动免疫反应,攻击移植受体器官,使发病率和死亡率显著提高。GVHD主要有两种形式,急性型,一般在移植后100天内发生;慢性型,一般在移植100天后发生。这两种形式都可对多个器官系统,包括皮肤、胃肠道(消化道)、肝脏造成影响。在美国,有超过14000人患有慢性GVHD,其中许多人面临严重的并发症,可能影响日常活动,并持续数年。
芦可替尼是一款first-in-class JAK1/JAK2抑制剂。诺华负责其片剂在美国以外地区商业化,商品名为Jakavi,Incyte则负责芦在美国的开发和商业化,商品名为Jakafi。芦可替尼片剂已在美国获批用于治疗移植物抗宿主病(GVHD)、骨髓纤维化、真性红细胞增多症。
FDA此次批准是基于代号为REACH3的III期临床研究结果。该研究比较了芦可替尼和最佳可用疗法(BAT)治疗类固醇难治性慢性GVHD的疗效。结果显示,第24周时, 芦可替尼组患者在主要终点总缓解率(ORR)上显著高于BAT治疗组(49.7% vs 25.6%,P<0.0001)。
芦可替尼最常见的血液学不良反应(发生率>35%)是贫血和血小板减少症。最常见的非血液学不良反应(发生率≥20%)是感染。
就在昨日,芦可替尼乳膏剂获FDA批准上市,用于短期和非连续性长期治疗非免疫功能低下的12岁及以上轻中度特应性皮炎 (AD) 患者,商品名为Opzelura,成为了FDA批准的首个也是唯一一个局部外用JAK抑制剂。Incyte拥有Opzelura的全球化开发和商业化权利。
来源:搜狐
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“明珠号”用户上传并发布,本平台仅提供信息存储服务。
-
 那 天然“促睾”食物被找到,男性若想提高活力,请舍得吃
那 天然“促睾”食物被找到,男性若想提高活力,请舍得吃 -
 预 每天喝酒,但喝不多,每次不超过2两,对身体是好事还是坏事?
预 每天喝酒,但喝不多,每次不超过2两,对身体是好事还是坏事? -
 大 空腹喝牛奶会拉肚子?关于喝牛奶的3个误区!
大 空腹喝牛奶会拉肚子?关于喝牛奶的3个误区! -
 李 老年人吃保健品有用吗?别再被骗!远离5类保健品,省钱又安全
李 老年人吃保健品有用吗?别再被骗!远离5类保健品,省钱又安全 -
 潇 好不容易准备结婚,杭州女孩却查出“接吻病”!医生提醒:这类人要小心!
潇 好不容易准备结婚,杭州女孩却查出“接吻病”!医生提醒:这类人要小心! -
 阳 养肝“冠军”被揪出,不是枸杞,饭后当零嘴吃,还你“婴儿肝”
阳 养肝“冠军”被揪出,不是枸杞,饭后当零嘴吃,还你“婴儿肝” -
 家 你认为的7个“好习惯”?或许在一点点剥夺你的健康!要谨记了
家 你认为的7个“好习惯”?或许在一点点剥夺你的健康!要谨记了 -
 人 转告家人:中老年人想要拥有好睡眠,睡前尽量不要做这5件事
人 转告家人:中老年人想要拥有好睡眠,睡前尽量不要做这5件事 -
 上 中药材掀“涨价潮”!返乡大学生回家“种药”,年入超40万元
上 中药材掀“涨价潮”!返乡大学生回家“种药”,年入超40万元 -
 人 新婚没多久,夫妻两人同时染上艾滋!妻子哭诉:都怪你兄弟!
人 新婚没多久,夫妻两人同时染上艾滋!妻子哭诉:都怪你兄弟! -
 人 瑞安航空乘客高空发生关系,翻云覆雨不顾旁人,航空公司视而不见
人 瑞安航空乘客高空发生关系,翻云覆雨不顾旁人,航空公司视而不见 -
 李 糖尿病人喝啤酒是否会导致血糖高,为什么?本文带你了解
李 糖尿病人喝啤酒是否会导致血糖高,为什么?本文带你了解









































